Ergänzende
Vorlesung im WS2004/2005:
7. Interaktionen und die Pathogenese von Infektionskrankheiten!
7.1.
Möglichkeiten der
Interaktion zwischen Pro- und Eucaryonten
Bezüglich
des Zusammenlebens von Mikro- und Makroorganismen gibt es ein vielfältiges
Spektrum von Beziehungen. Im einfachsten Fall beobachtet man eine Koexistenz
ohne dass einer der beiden „Parteien“ einen Vor- oder Nachteil hat. Hier wären
bei oberflächlicher Betrachtung die Mikroorganismen der à
physiologischen Flora zu nennen, die jedoch bei differenzierter Betrachtung dem
Makroorganismus einen Vorteil einbringen. Durch ihre Präsenz stellt die
physiologische Flora eine Barriere gegenüber eindringenden Mikroorganismen dar.
Erleidet einer der beiden Partner durch den anderen einen Schaden, so ist der
schädigende Partner der Parasit.
Wenn
beide Partner einer Beziehung Vorteile genießen, spricht man von einer Symbiose.
Die wohl engste Symbiose im Lauf der Evolution sind Cyanobakterien
bzw. Eubakterien mit Eucaryonten-Vorläufer
eingegangen. Durch stabile Integration der Cyanobakterien
entwickelten sich die Vorläufer der heutigen Pflanzenzellen, wobei die Cyanobakterien die Position der heutigen Chloroplasten einnehmen und damit der Pflanze überhaupt
erst die Möglichkeit zur Kohlenstoffassimilation (Photosynthese) geben (Grundlage für die Entwicklung höheren Lebens
auf der Erde). Die Eubakterien entwickelten sich
zu Mitochondrien, die im Laufe der Evolution den gesamten Energiestoffwechsel
der Eucaryontenzelle übernahmen. Die zu Grunde
liegende Theorie ist die so genannte Endosymbiontentheorie.
Frage zur eigenen Auseinandersetzung mit
dem Stoff:
Benennen sie weitere Formen der Symbiose, die Ihnen aus dem
Zusammenleben von Bakterien und Menschen bekannt sind:
In
der Medizinischen Mikrobiologie unterscheidet man außerdem noch zwischen einer
Besiedlung und einer Infektion. Die Besiedlung kann im Rahmen einer Symbiose
oder einer kommensalischen Beziehung zustande kommen,
wobei durchaus auch pathogene Bakterien den Menschen besiedeln können, ohne das
daraus eine Krankheit erwächst. Man spricht von transienter
Besiedlung wenn es sich um eine zeitlich begrenzte Besiedlung handelt oder von
der residenten Flora, wenn die Besiedlung von Dauer ist.
Von
Infektion spricht man immer dann, wenn Erreger in den Makroorganismus eindringen
und eine Immunreaktion auslösen. Wenn es zu einer Infektion kommt, der
Makroorganismus aber nicht erkrankt sondern nur mit der Bildung von Antikörpern
reagiert (Immunreaktion) liegt die sogenannte stille
Feiung vor (verg. Impfung).
Kommt
es nach der Infektion zu einer Erkrankung unterscheidet man zwischen manifesten
und latenten Infektionen bzw. zwischen akuten oder chronischen Infektionen.
Latente Infektionen sind solche, bei denen der Patient nach einer Phase
klinisch manifester Symptome wieder Symptom-frei
ist, den Erreger aber noch in sich trägt (verg. z.B. Tuberkulose). Die Latenz ist nicht dasselbe wie die
Inkubationszeit! Infektionen können chronisch sein, wenn die manifesten Symptome
über längere Zeit präsent sind.
Frage zur
eigenen Auseinandersetzung mit dem Stoff:
Welche anderen Infektionskrankheiten zeigen
Latenzzeiten?
7.2.
Immunsystem,
Infektionsprophylaxe bzw. antiepidemische Maßnahmen
Einführung
in den Aufbau des Immunsystems des Menschen
Zur
Infektionsabwehr verfügt der
menschliche Organismus über drei Systeme: die unspezifische Infektabwehr, die spezifische Infektabwehr und das immunologische Gedächtnis. Die
zweite und die dritte Verteidigungslinie richten sich immer nur gegen einen
(spezifischen) Erreger. Im Gegensatz zur unspezifischen Infektabwehr werden
die Leistungen der spezifischen Infektabwehr und das immunologische Gedächtnis
durch den Kontakt mit den Erregern erst gebildet und moduliert, die speziellen
Fähigkeiten sind also nicht
angeboren sondern erworben. Angeboren sind nur die Grundlagen der spezifischen
Infektabwehr!
7.2.1.
unspezifische
Infektabwehr:
• Haut und
Schleimhäute als natürliche Barrieren
a.) mechanische Barriere
b.) chemische Barriere über ungesättigte
Fettsäuren, die von den Talgdrüsen der Haut abgegeben werden; sog. Säureschutzmantel
• physiologische
Standortflora (die Keime die zur
Normalbesiedlung gehören) treten mit fremden Keimen in eine Nahrungs- und
Standortkonkurrenz und scheiden Antibiotika aus.
• mechanische
Spüleffekte durch allerlei
Körperflüssigkeiten wie Tränen, Speichel, Urin usw. Tränen und Speichel
beinhalten Lysozym
(natürlich vorkommendes Antibiotikum, das bevorzugt auf Gram positive Keime
wirkt und das Murein abbaut, dadurch bakterizider Effekt; siehe Zellwand).
• pH-Wert von Körperflüssigkeiten
(Magensaft, Vaginalsekret usw.), die vielen Bakterien zu sauer sind (Ausnahme sind z.B. Helicobacter pylorii im Magen oder Lactobacillen in der Vagina).
Hinzu
kommen im Blut zirkulierende Granulozyten, Neutrophile
etc. sowie Monozyten und Makrophagen,
die, zunächst unspezifisch, einmal eingedrungene Erreger phagozytieren
und abtöten können. Daraus resultieren Entzündungen! Entzündungen führen zu
lokalen Temperaturerhöhungen die ihrerseits eine abwehrende Wirkung auf
Bakterien haben. Darüber hinaus führen Entzündungen zur Freisetzung
chemotaktischer Signale an Zellen des spezifischen Immunsystems.
7.2.2.
spezifische
Infektabwehr
Das
B-Zell-System
trägt die humorale Immunantwort. Jede B-Zell-Linie
weist auf ihrer Oberfläche Antigen-Rezeptoren
auf, welche die Antigenerkennung vermitteln. Im Körper eines erwachsenen
Menschen kreisen etwa 108 verschiedene
B-Zell-Linien mit unterschiedlicher Antigenerkennung
(Spezifität).
Wenn
B-Lymphocyten über den Antigen-Rezeptor ein Antigen (Epitop) erkennen, erfolgt unter Mithilfe des
T-Zell-Systems (s.u.) die Aktivierung und nachfolgend
die Bildung und Sekretion spezifischer Antikörper (Ak).
B-Zell-Klone, die aktiviert wurden, differenzieren sich in Plasmazellen
(starke Ak-Produktion) und Gedächtniszellen
(reagieren bei erneutem Antigenkontakt schnell mit der Bildung von Ak`s; Sekundärantwort, s.u.).
Kommt das Immunsystem das erste Mal mit einem Antigen in Berührung, erfolgt die
Primärantwort, während der nach einigen Tagen IgM-Moleküle gebildet werden (IgG spielen nur eine untergeordnete Rolle). Bei einem
zweiten Kontakt reagieren die Gedächtniszellen und bilden sehr schnell hohe IgG-Titer im
Serum (Sekundärantwort).
Das T-Zell-System ist der
Träger der zellulären Immunantwort. T-Zellen werden nach dem folgenden Schema
in Untergruppen unterteilt:
Tabelle 9: Grobeinteilung der T-Lymphocyten ohne Berücksichtigung von TH-Subpopulationen.
|
CD4+ oder T-Helfer-Zellen |
CD8+ oder cytotoxische
Zellen |
|
Helfer- oder Induktorfunktion |
cytolytisch oder Suppressorfunktion |
|
[CD2+, CD3+, CD4+,
CD8-] |
[CD2+, CD3+, CD4-,
CD8+] |
|
Funktion: |
Funktion: |
|
B-Zelldifferenzierung |
Killerzellen, lysieren Zellen nach Kontakt (Porenbildung ähnlich des
Komplementsystems) |
|
Reifung von
CD8+-cytolytischen Zellen |
|
|
Makrophagenaktivierung |
|
CD4+
und CD8+ Zellen liegen normalerweise im Verhältnis 2:1 vor. Bei der Immunschwächekrankheit
AIDS verschiebt sich das Verhältnis durch den Ausfall der CD4+ Zellen (in denen
sich das HI-Virus vermehrt) auf <<1:1. CD8+-Zellen übernehmen die
Virusabwehr in körpereigenen Zellen!
T-Zellen
sind ebenfalls in der Lage sich in Gedächtniszellen zu differenzieren, jedoch
seltener und mit geringerer praktischer Relevanz als bei B-Zellen.
7.2.3.
Vorgänge während
der Immunantwort
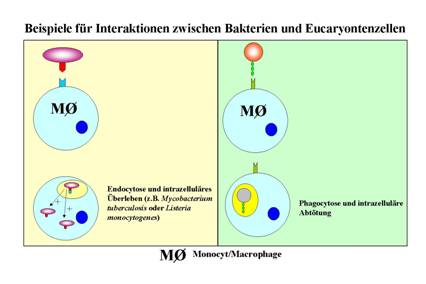
Phagozytierende Zellen (Leukozyten wie Monocyten oder Granulocyten) erkennen
eindringende Mikroorganismen auf Grund bestimmter Oberflächenantigene. Nach
Erkennung erfolgt die Phagocytose eingedrungener
Bakterien (Abb. 24). Die Phagosomen verschmelzen mit Lysosomen zu Phagolysosomen in
denen die Verdauung des Antigens stattfindet. Teile des Antigens werden dem
zellulären Ast des Immunsystems mittels des Haupthistokompatibilitätskomplex
(antigenpräsentierende Oberflächenmoleküle, englisch
MHC für Major Histocompatibility Complex)
präsentiert. Hierbei erfolgt die Antigen-spezifische Aktivierung von T-Zellen.
CD4+-T-Zellen aktivieren daraufhin B-Zellen, wenn diese vorher ebenfalls Kontakt mit dem Antigen hatten. Die B-Zellen
differenzieren zu Plasmazellen und reagieren dann
mit der Bildung von Antikörpern. Einzelne Mikroorganismen haben die Fähigkeit
entwickelt, der intrazellulären Abtötung zu entgehen (Abb. 24). Das
intrazelluläre Überleben solcher Bakterien kann zur Bildung von Granulomen wie z.B. bei der Tuberkulose
führen.
Abb. 24:
Erreger werden
von phagocytierenden Zellen erkannt und
internalisiert (rechts). Die intrazelluläre Abtötung ist der erste Schritt in
der Infektionsabwehr, während das intrazelluläre Überleben (links) zur
Krankheit führen kann (z.B.
à
Tuberkulose;
à
Pathogenitätsfaktoren).
Mit
Hilfe von Impfungen versucht man, die Primär- und Folgeantworten des
Immunsystems auf einen gegebenen Erreger vorwegzunehmen. Ziel ist dabei die
Vermeidung von Krankheiten und das Durchbrechen von Infektionsketten. Impfungen
haben zumindest in den Industrienationen zu einem gewaltigen Rückgang der
wichtigsten Infektionskrankheiten geführt und die Lebensqualität entscheidend
verbessert (Überblick über die Entwicklung in den USA gibt: Dennehy PH (2001): Active
Immunization in the United States: Developments over the past
decade. Clin. Microbiol. Reviews
14(4):872-908). Durch die damit einhergehende höhere Produktivität der
Bevölkerung haben sich Impfstoffe zu den Präparaten mit dem bei weitem besten
Kosten-Nutzen Verhältnis entwickelt. (Informationen zu Impfungen und zum
gültigen Impfkalender in Deutschland finden sich bei der Ständigen
Impfkommission (STIKO) am Robert-Koch-Institut:
http://www.rki.de/GESUND/IMPFEN/IMPFEN.HTM).
7.3.
Die Rolle von Pathogenitätsfaktoren bei der Krankheitsentstehung
Gelangen Mikroorganismen in den Makroorganismus
(Infektion) so entscheiden die Pathogenitätsfaktoren
der Bakterien über den Erfolg oder Misserfolg der Infektion (aus Sicht des
Bakteriums: Besiedlung eines neuen Lebensraum, Vermehrung und Erhaltung der
eigenen Art, im optimalen Fall weitere Verbreitung). Mikroorganismen weisen eine Reihe von Merkmalen auf, die es ihnen
ermöglichen, diese Ziele zu erreichen. Diese Merkmale werden wegen ihres
Potentials zur Auslösung von Immunreaktionen bzw. wegen ihres Potentials, dem
Erreger das Überleben im Wirt zu ermöglichen Pathogenitätsfaktoren
oder Virulenzfaktoren genannt (à
Tabelle 9). Dies können sein:
Ø
Toxine (Exotoxine, Enterotoxine) werden von Bakterien ins Milieu abgegeben.
Ø
die Fähigkeit zum intrazellulären Überleben
Ø
Bestandteile der Zellwand/äußeren Membran, welche der Adhärenz und Invasion der Erreger an bzw. in Wirtszellen
dienen.
Ø
sowie Merkmale oder die Fähigkeit, sich beispielsweise
durch Bildung einer Schleimkapsel oder durch Bildung einer Kapsel aus
wirtseigenem Material der Immunantwort des Wirtes zu entziehen.
In
der Regel wirken mehrere Pathogenitätsfaktoren bzw.
Eigenschaften zusammen, um die oben genannten Ziele der Mikroorganismen
durchzusetzen.
Tabelle 10: Auswahl von Pathogenitätsfaktoren und -mechanismen
bzw. die Pathogenität fördernder Eigenschaften bei
Bakterien
|
Virulenzeigenschaften |
Beispiel Erreger |
Pathogenitätsfaktor |
|
Neurotoxine |
Clostridium botulinum |
Botulinum-Toxin |
|
|
Clostridium tetani |
Tetanus-Toxin |
|
|
|
|
|
Enterotoxine |
Staphylococcus aureus |
Enterotoxin A-E |
|
|
Vibrio cholerae |
Cholera-Toxin |
|
|
|
|
|
Exotoxine |
Prevotella spec. |
|
|
|
Acinobacillus spec. |
|
|
|
Streptococcus pyogenes |
lysogene Phagen |
|
|
Escherichia coli |
Enterotoxin |
|
|
Clostridium perfringens |
mehrere Toxine |
|
|
|
|
|
|
|
|
|
Listeria monocytogenes |
in Monocyten |
|
|
|
Mycobacterium tuberculosis |
in Macrophagen |
|
|
Chlamydia trachomatis |
|
|
|
Mycoplasma pneumoniae |
|
|
|
|
|
|
Endotoxin Freisetzung |
Neisseria meningitidis |
gram negative Erreger |
|
|
|
|
|
Yersinia entercolitica |
Adhäsin |
|
|
|
Salmonella enterica |
Adhäsin |
|
|
Streptococcus mutans |
Adhäsine |
|
|
Actinobacillus actinomycetemcomitans |
Adhäsine |
|
|
Prevotella spec Bacteroides spec. |
Adhäsine |
|
|
Neisseria gonorrhoeae |
Pili; opacity proteine (OPA) |
|
|
Neisseria meningitidis |
OPA? |
|
|
|
|
|
Invasion von Wirtszellen |
Shigella dysenteriae
Neisseria gonorrhoeae |
OPA |
|
|
|
|
|
Abkapseln, Abszesse |
Staphylococcus aureus |
Koagulase/Clumping factor etc. |
7.4.
Toxine als Pathogenitätsfaktoren
Übersicht
über bakterielle à
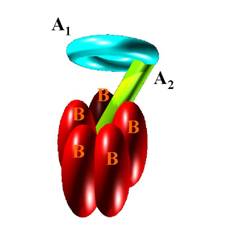
Toxine und deren Wirkung auf Zellen des Makroorganismus. Bakterielle Toxine
weisen nicht selten zwei Untereinheiten auf (Abb. 25), eine Rezeptorbindende Domäne
(ermöglicht die Anbindung an Oberflächenrezeptoren der Wirtszelle) und eine
toxische Domäne, welche in der Wirtszelle die eigentlichen Effekte auslöst.
Beispiel: Choleratoxin (Abb. 25): Toxin aus zwei Untereinheiten
(A1-A2 und B(5)). Die B-Untereinheiten stellen
die Rezeptorbindende Domäne dar, die A1-A2 Untereinheit
entfaltet die toxische Wirkung welche darin besteht, den intrazellulären cAMP-Spiegel zu stören und dadurch zu einer massiven
Hypersekretion von Salzen und Wasser ins Dünndarmlumen zu führen (eine animierte PowerPoint Präsentation zur Toxinwirkung durch Klick auf den folgenden link starten: PowerPoint2003 Animation/PowerPoint 95 und höher Animation). Der dadurch entstehende Wasserausstrom kann verheerende Folgen annehmen, einzelne Patienten verlieren —unbehandelt— bis zu 20 l Wasser am Tag auf Grund dieser Durchfälle.
7.5. Pathogenese der Salmonellose
Beispiel
für das komplexe Zusammenspiel von Wirts- und Gastfaktoren für die Pathogenese
von Erkrankungen ohne Beteiligung von toxischen Produkten der Bakterien. Die
Infektion mit enteritsichen Salmonellen erfolgt in
aller Regel über die orale Aufnahme der Bakterien, die, wenn sie die saure
Magenpassage überstehen, über folgende Ereigniskette zur Entstehung des
Durchfalls führen.
Ø
Adhärenz der Bakterien an Epithelzellen der Darmschleimhaut.
Ø
Durchwandern der Epithelzellen bis zur Lamina propria
Ø
Entzündliche Reaktion an der Infektionsstelle
Ø
Migration von polymorphkernigen Leukozyten zur
Infektionsstelle
Ø
Ausschüttung von proinflammatorischen
Substanzen (Prostaglandine)
Ø
chemotaktische Wirkung auf weitere polymorphkernigen
Leukozyten und weitere Entwicklung der lokalen Entzündungsreaktion
Ø
Prostaglandinfreisetzung führt zur Rückresorption von Wasser ins Darmlumen und damit zum Durchfall
Der
Durchfall stellt also eine Abwehrreaktion des Makroorganismus dar, welcher
durch massive Ausscheidung des Erregers die Infektion zu kontrollieren versucht
und dabei andererseits die weitere Verbreitung des Erregers sicherstellt. Im
Ergebnis muss man daher eine sehr weitgehende Anpassungsleistung der
Salmonellen an den menschlichen Organismus postulieren.
Die
enteritischen Salmonellen selbst sind folglich nur
ein Teil der manifesten Erkrankung, der andere Teil der manifesten Infektion
ergibt sich aus der Abwehrreaktion des Makroorganismus selbst!
7.6. Pathogenese der Parodontose
Eine
ähnlich gelagerte Situation ergibt sich im Hinblick auf die Entstehung der
Parodontose. In diesem Fall kommt den Erregern aber wahrscheinlich ein eigenes
toxisches Potential zu. Die à
Adhärenz der Erreger an die Zellen des
Makroorganismus sowie die Ausschüttung von Toxinen stehen bei der Parodontose
im Vordergrund. Als Reaktion auf diese Vorgänge gelangen polymorphkernigen
Leukozyten zum Infektionsort wo sie eine Entzündung
auslösen, welche wiederum zusammen mit den Toxinen den Knochenabbau begünstigt.
Als Parodontoseerreger gelten zurzeit z.B. Actinobacillus actinomycetemcomitans
und Prophyromonas
gingivalis.
Die
Pathogenese der Parodontose kann über sehr komplexe Wechselwirkungen
beeinflusst werden, wie am Beispiel der Parodontose bei Kälbern in Brasilien
erläutert wird. Hier wird die Entstehung der für die Kälber letalen Parodontose
durch Umwelteinflüsse (Rodung und Veränderung des Mikroklimas auf Primärweiden)
getriggert, die eine Veränderung der Maulflora und damit die Parodontose
bewirken.
7.7.
Pathogenese von S. aureus Abszessen
Ein
Beispiel für einen Erreger, bei dem die Wirkung von Exoenzymen
und Zellwand-gebundenen Faktoren buchstäblich Hand in
Hand zusammenwirken ist Staphylococcus aureus, ein
vor allem in Kliniken gefürchteter Eitererreger, der als klassischer Erreger
von à Abszessen, Furunkeln oder Karbunkeln
gilt.
Nach
Eindringen in die Haut erfolgt die Ausbreitung im Gewebe durch die Hyaluronidase (Exoenzym), welches
Zell-Zell-Verbindungen aus Hyaluronsäure spaltet. Mit
Hilfe seiner Pathogenitätsfaktoren kapselt sich
dieser Erreger im Gewebe ein, in dem er eine Kapsel aus Fibrin um sich herum
lagert, die vor dem direkten Zugriff der Immunantwort effektiv schützt.
Beteiligt an diesem Prozess sind der Zellwand gebundene clumping
factor und die freie Plasmakoagulase
des Erregers. Der Makroorganismus reagiert mit der Bildung einer Entzündung um
den lokalen Infektionsherd, was letztlich zum Abszess führt. Durch Fibrinolysin (Staphylokokken-eigenes
Fibrinolysin = Staphylokinase),
ein weiteres Exoenzym, ist der Erreger später in der
Lage, sich aus dieser Kapsel zu „befreien“ und unter Umständen systemisch zu
streuen.
7.8.
Pathogenese der
Tuberkulose
Manifeste
Infektionskrankheiten stellen also oft eine Kombination aus Toxizität des
Erregers und daraus resultierender Immunantwort dar. Im extremen Fall ist die
Immunantwort überwiegend für die Symptome verantwortlich. So ist der Erreger
der Tuberkulose
(M. tuberculosis)
an sich kaum invasiv bzw. toxisch. Vielmehr entstehen
die pathologischen Veränderungen im Lungengewebe durch die Wirkung der
Abwehrzellen selbst (Abb. 26/27). Nach Inhalation gelangen die Erreger in die Alveolarmakrophagen der Lunge. Zwar werden die
Mykobakterien phagocytiert doch haben sie die
Fähigkeit, sich intrazellulär in den Makrophagen zu
vermehren (à intrazelluläres Überleben). Im
weiteren Verlauf der Tuberkulose gelangen weitere Zellen des Wirtes (CD4+
T-Helfer Zellen und Makrophagen) zur Stelle der
Primärinfektion und bedingen so die Schäden am Lungengewebe (Granulome), die röntgenologisch sichtbar sind. Die
Tuberkulose kann als latente Infektion vorliegen, in solchen Fällen kann es
nach Jahren oder Jahrzehnten zu einer Reaktivierung kommen (oft im
„Rentenalter“ auf Grund der nachlassenden Leistungen des Immunsystems).
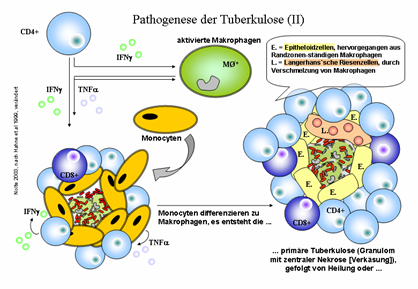
Abb. 26: Erste Schritte in der Entstehung der Tuberkulose. Das Granulom, welches die Grundlage für spätere evtl.
Lungenschäden bildet, dient eigentlich primär der Abwehr des Erregers. Diese
Abwehr führt auch bei dem überwiegenden Teil der Patienten zur Kontrolle der
Infektion. Bei einem Teil der Patienten entwickelt sich jedoch im weiteren
Verlauf eine offene Tuberkulose:
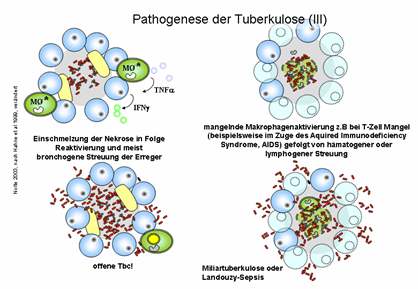
Abb. 27: Entwicklung der
offenen TB aus den Granulomen.
Frage zur eigenen Auseinandersetzung mit
dem Stoff:
Versuchen Sie an Hand von Lehrbüchern weiter Beispiele für Krankheiten zu finden, deren manifeste Symptomatik nicht alleine durch die Wirkung bakterieller Toxine zu Stande kommt!
Frage zur eigenen Auseinandersetzung mit
dem Stoff:
Studieren Sie in Lehrbüchern die Sepsis durch Gram-negative Bakterien
und überlegen Sie, welche Rolle die Bakterien selbst in der Sepsisentstehung
spielen und welche Faktoren des Menschen den Verlauf der Sepsis beeinflussen!
7.9.
The male killing bacterium
...
eine besondere Form der Interaktion
Ursprünglich
bei Marienkäfern hat man eine Bakterienart entdeckt, Wolbachia ssp., die als „Männer-mordendes“ Bakterium bekannt wurde.
Wolbachia lebt im Cytoplasma
weiblicher Eizellen —einem im Vergleich zum Spermium ausgesprochen reichhaltigen
Lebensraum— und hat diverse Strategien entwickelt, die Ausprägung des
männlichen Geschlechts in einer befallen Art zu verhindern (Männchen sind für Wolbachia
nutzlos, da sie sich in ihnen nicht weiter entwickeln können). Die Mechanismen
reichen von der Feminisierung männlicher Embryonen durch Freisetzung eines
antiandrogynen Hormons über das Abtöten männlicher Embryonen bis hin zur cytoplasmatischen Inkompatibilität, die Verhindern soll,
das mit Wolbachia
infizierte Männchen nicht infizierte Weibchen befruchten können. Kurz, Wolbachia
unternimmt alles, um die Entwicklung eines Männchen in
der befallenen Art zu verhindern und hat damit bereits eine Schmetterlingsart
an den Rande der Extinktion gebracht. Wolbachia lebt vermutlich
in einem Fünftel aller Insekten und wurde jüngst auch in Helminthen
nachgewiesen.
Bei
Helminthen wurde berichtet, dass eine Behandlung der Filarien
mit Tetracyclin zum Absterben der Wolbachien
und damit zu einer Störung der Entwicklung der männlichen Filarien
führt. Die Methode wird unter dem Namen „Wolbachien-Depletion“
zurzeit näher untersucht und wird als ein möglicher Ansatz gesehen, dass
Problem der parasitischen Wurminfektion in den Entwicklungsländern unter
Kontrolle zu bekommen. Erste Feldversuche in Afrika zeigen positive Resultate.
Patienten mit Onchocerciasis, ausgelöst durch den
parasitischen Wurm Wucheria bancrofti,
wurden mit Doxycyclin behandelt, um gezielt die Wolbachien in den weiblichen Filarien
abzutöten. Im Effekt kam es zu einer Reduktion der Filarien
bei den Patienten (siehe Hoerauf et al 2003).
(zur
näheren Information siehe: Hörauf,
A. (2002): Wolbachien – Zielstrukturen für eine neue
Chemotherapie von Filariosen. BIOforum
4/2002:234ff und darin zitierte Primärliteratur
Hoerauf A, Mand S, Fischer K, et al
(2003): Doxycycline as a novel
strategy against bancroftian filariasis – depletion of Wolbachia endosymbionts from Wucheria bancrofti and
stop of microfilaria production. Med. Microbiol. Immunol 192:211-216 [Zeitschrift z.B. in der Bibliothek des
Hygiene-Instituts])